Absorptionsspektrum - Homepage WEE-Solve GmbH
Hauptmenü:
- Home
- Menütrennlinie 7
- Über uns
- Menütrennlinie 1
- Fraktionierung
- Menütrennlinie 4
- Rheologie
- Menütrennlinie 5
- Auftragsforschung
- Menütrennlinie 6
- Auftragsanalytik
- Menütrennlinie 8
- Kontakt
Absorptionsspektrum
Bei UV/Vis-
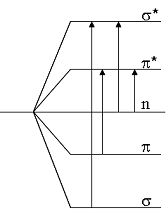
Molekülorbitale und Elektronenübergänge
Die Anregung der Elektronen ist stets mit einer ganzen Reihe möglicher Schwingungs-

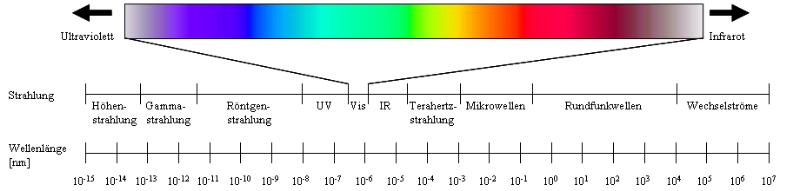
Strahlungsarten und ihr Wellenlängenbereich
Die Absorptionsspektroskopie kann sowohl in der qualitativen als auch in der quantitativen Analytik eingesetzt werden: Aufgrund der Form und der Lage der Absorptionsbanden können qualitative Aussagen über das Molekül gemacht werden, was z.B. bei der Strukturaufklärung genutzt werden kann. Die starke Absorption lässt sich meist auf das Vorhandensein von spezifischen Strukturelementen (sog. Chromophore) zurückführen, wobei diese die Vorraussetzung für Elektronenübergänge schaffen. Das gemessene Absorptionsspektrum gibt also Hinweise auf das Vorhanden sein oder das Fehlen gewisser funktioneller Gruppen im Molekül.
Die Tabelle zeigt einige chromophore Gruppen und deren Absorptionsmaxima:
Chromophor |
Absorptionsmaximum |
Carbonylgruppe (Ketone) RR'C=O |
271 nm |
Carbonylgruppe (Aldehyde) RHC=O |
293 nm |
Carboxylgruppe RCOOH |
204 nm |
Amidogruppe RCONH2 |
208 nm |
Azogruppe - |
339 nm |
Nitrogruppe - |
280 nm |
Die exakten Wellenlängen der Absorptionsbanden hängen neben den Substituenten der Verbindung auch noch vom Lösungsmittel bzw. von dessen Polarität ab. Bei steigender Lösungsmittelpolarität kommt es zu einer Verschiebung zu kleineren Wellenlängen (hypsochrome Verschiebung). Eine sinkende Polarität des Lösungsmittels verursacht dahingegen eine Verschiebung des Absorptionsspektrums zu höheren Wellenlängen (bathochrome Verschiebung).
Die Lage und die Intensität des Absorptionsmaximums ist allerdings noch zusätzlich von anderen Parametern wie dem pH-
Hier sind einige Beispiele aufgeführt, die durch Absorptionsspektroskopie identifiziert werden können:
Ungesättigte Ringe und C-
C- Mehrfachbindungen Kondensierte Aromaten und ungesättigte Heterocyclen und Homocyclen
Konjugation und Kumulation
Untersuchung von Gleichgewichten:
Protolytische Gleichgewichte
Komplexbildungsgleichgewichte
Charge-
Übergangsmetallkomplexe
In der quantitativen Analytik sind die im Allgemeinen sehr großen molaren Extinktionskoeffizienten verantwortlich dafür, dass die UV/Vis-
Einige mögliche Bestimmungen sind:
Elementbestimmung mit Hilfe von Komplexbildnern (z.B. Dithizon-
Verfahren) Anionen-
und Ammoniakbestimmung mittels Farbreagenzien Photometrische Wasseranalysen von Kationen und Anionen mittels Farbreagenzien
Bestimmung organischer Verbindungen, v.a. konjugierter Systeme